Acide dinitrobenzoïque
L'acide dinitrobenzoïque est un composé aromatique de formule C7H4N2O6. Il est constitué d'un cycle benzénique substitué par un groupe carboxyle (acide benzoïque) et par deux groupes nitro. Il existe sous la forme de six isomères, en fonction de la position respective de ces groupes.
Propriétés
| Acide nitrobenzoïque | ||||||
| Nom | Acide 2,3-dinitrobenzoïque | Acide 2,4-dinitrobenzoïque | Acide 2,5-dinitrobenzoïque | Acide 2,6-dinitrobenzoïque | Acide 3,4-dinitrobenzoïque | Acide 3,5-dinitrobenzoïque |
| Formule structurelle |  |  | 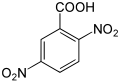 |  |  |  |
| Numéro CAS | 15147-64-5 | 610-30-0 | 610-28-6 | 603-12-3 | 528-45-0 | 99-34-3 |
| PubChem | 283327 | 11880 | 11879 | 119206 | 10709 | 7433 |
| Formule brute | C7H4N2O6 | |||||
| Masse molaire | 212,12 g·mol−1 | |||||
| État | solide | |||||
| Apparence | poudre cristalline jaunâtre | |||||
| Point de fusion | 201 °C[1] | 179 à 183 °C[2] | 178 à 182 °C[3] | 202 °C (décomposition)[1] | 166 °C[4] | 204 à 206 °C[5] |
| PkA | 1,85[6] | 1,42[6] | 1,62[6] | 1,14[6] | 2,82[6] | 2,82[6] |
| Solubilité dans l'eau | 18,5 g·l-1 (25 °C)[2] | 6,73 g·l-1 (25 °C)[4] | ||||
| SGH |  Attention |  Attention |  Attention | |||
| Phrase H et P | H315, H319 et H335 H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux H335 : Peut irriter les voies respiratoires | H315, H319 et H335 H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux H335 : Peut irriter les voies respiratoires | H302, H315, H319, H335 et H413 H302 : Nocif en cas d'ingestion H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux H335 : Peut irriter les voies respiratoires H413 : Peut entraîner des effets néfastes à long terme pour les organismes aquatiques | |||
| P261 et P302+P352 P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P302+P352 : En cas de contact avec la peau : laver abondamment à l’eau et au savon. P321, P305+P351+P338, P405 et P501 P321 : Traitement spécifique (voir … sur cette étiquette). P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P405 : Garder sous clef. P501 : Éliminer le contenu/récipient dans … | P261 et P305+P351+P338 P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. | P261 et P305+P351+P338 P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. | ||||
Les acides dinitrobenzoïques sont des solides cristallins jaunâtres dont le point de fusion se situe entre 166 et 206 °C. Les acides dinitrobenzoïques ont une acidité plus élevée que l'acide benzoïque et les acides nitrobenzoïques en raison de l'effet -M des deux groupes nitro, en particulier lorsqu'ils sont adjacents au groupe carboxyle (position ortho). Les pkA varient ainsi entre 1,14 (isomère 2,6, en double position ortho) et 2,82, et sont globalement plus faibles que ceux des acides nitrobenzoïques (2,22-3,44), et bien plus faible que celui de l'acide benzoïque (4,20[6]).
Synthèse
Le 2,4-dinitrotoluène peut être oxydé en acide 2,4-dinitrobenzoïque avec du dichromate de sodium dans de l'acide sulfurique[7]. Un mélange d'acide 2,4- et 3,4-dinitrobenzoïque est formé par réaction entre l'acide 4-nitrobenzoïque avec de l'acide nitrant (de)[7]. Le 2,6-dinitrotoluène est métabolisé en acide 2,6-dinitrobenzoïque[8]. L'oxydation du 3,4-dinitrotoluène avec un mélange d'ozone et d'oxygène en présence d'acétate de cobalt(II) donne de l'acide 3,4-dinitrobenzoïque[9].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Dinitrobenzoesäuren » (voir la liste des auteurs).
- ↑ a et b (en) Edward Wight Washburn, International Critical Tables of Numerical Data, Physics, Chemistry and Technology, vol. 1, National Academies, (lire en ligne), p. 206
- ↑ a et b Entrée « 2,4-Dinitrobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-02-03 (JavaScript nécessaire).
- ↑ Fiche Sigma-Aldrich du composé 2,5-Dinitrobenzoic acid, consultée le 2021-02-03.
- ↑ a et b Entrée « 3,4-Dinitrobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-02-03 (JavaScript nécessaire).
- ↑ Fiche Sigma-Aldrich du composé Acide dinitrobenzoïque.
- ↑ a b c d e f et g CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6).
- ↑ a et b (de) Streitwieser/Heathcock, Organische Chemie, Weinheim, Verlag Chemie, , 1re éd. (ISBN 3-527-25810-8), p. 1042.
- ↑ M. Mori, T. Kawajiri, M. Sayama, Y. Taniuchi, T. Miyahara, H. Kozuka, « Metabolism of 2,6-dinitrotoluene in male Wistar rat », Xenobiotica, vol. 19, no 7, , p. 731–741 (PMID 2773509).
- ↑ P. Yu. Andreev, E. V. Potapenko, I. P. Pogorelova, S. N. Krasil’nikov, A. N. Band, « A New Procedure for Preparing 3,4-Dinitrobenzoic Acid », Zhurnal Prikladnoi Khimii, vol. 81, no 3, , p. 518–520
Voir aussi
- Nitrobenzène
- Acide benzoïque
- Acide nitrobenzoïque
- Acide trinitrobenzoïque
 Portail de la chimie
Portail de la chimie












