Reattivo di Schwartz
| Reattivo di Schwartz | |
|---|---|
 | |
| Nome IUPAC | |
| bis(η5-ciclopentadienil)cloroidrozirconio(IV) | |
| Abbreviazioni | |
| reattivo di Schwartz | |
| Nomi alternativi | |
| cloruro idruro di bis(ciclopentadienil)zirconio, cloruro idruro di zirconocene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H11ClZr |
| Massa molecolare (u) | 257,87 |
| Aspetto | solido bianco[1] |
| Numero CAS | 37342-97-5 |
| Numero EINECS | 253-479-5 |
| PubChem | 21879930 |
| SMILES | [H-].C1C=CC=[C-]1.C1C=CC=[C-]1.[Cl-].[Zr+4] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  | |
| Frasi H | 261 - 314 [1] |
| Consigli P | 231+232 - 260 - 280 - 305+351+338 - 370+378 - 402+404 [1] |
| Modifica dati su Wikidata · Manuale | |
Il reattivo di Schwartz è il composto organometallico con formula (η5-C5H5)2Zr(H)Cl, a volte abbreviata come Cp2Zr(H)Cl. Questo complesso di zirconio fu ottenuto per la prima volta da Wailes e Weigold nel 1970,[2] e prese il nome reattivo di Schwartz nel 1974 quando il chimico statunitense Jeffrey Schwartz lo utilizzò per sviluppare le reazioni di idrozirconazione.[3] Disponibile in commercio,[1] Cp2Zr(H)Cl in condizioni normali è un solido bianco, sensibile all'aria, all'umidità e alla luce.[4] Trova applicazione in sintesi organica per varie trasformazioni, soprattutto per alcheni e alchini.[5]
Struttura

Il composto adotta la struttura tipo metallocene piegato simile a quella di svariati altri complessi Cp2MX2. Misure di diffrazione elettronica su microcristalli (MicroED)[6] e di spettroscopia FT-IR[2] hanno evidenziato una struttura dimera con gli idruri a ponte tra i due centri metallici (Figura 1).
Sintesi
Il reattivo di Schwartz si può preparare riducendo il dicloruro di zirconocene con LiAlH4:
Durante la reazione si forma anche Cp2ZrH2, che trattato con diclorometano si trasforma a sua volta in Cp2Zr(H)Cl.[4] Come riducente si può usare LiAl(O-t-Bu)3H al posto di LiAlH4.[7]
Applicazioni
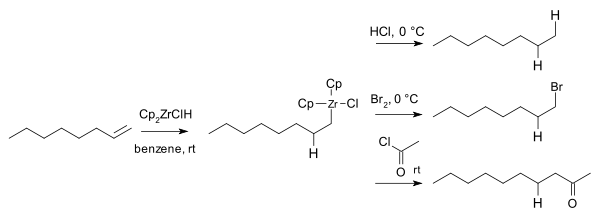
L'impiego di Cp2Zr(H)Cl in sintesi organica ha attratto interesse perché questo reattivo è poco costoso, facile da preparare, e induce una varietà di reazioni in condizioni blande con alta resa.[3] La reazione più comune è l'idrozirconazione (un tipo di idrometallazione): un legame Zr-H viene addizionato a un legame insaturo (ad esempio un alchene RC=CR) per dare un intermedio con un legame Zr-C (RHC-CRZr), intermedio che può in seguito reagire ulteriormente. La reazione di idrozirconazione è usata spesso per funzionalizzare alcheni e alchini.[8] Ad esempio gli alcheni formano intermedi che possono poi fornire alcani, bromoalcani e chetoni tramite reazioni con elettrofili come acido cloridrico, bromo e cloruri acilici:
Alcuni dei numerosi altri possibili impieghi del reattivo di Schwartz sono:[5][9] formazione di legami C-C,[8] formazione e apertura di cicli,[8] riduzione di amidi ad aldeidi,[10] vinilazione di chetoni,[11] sintesi di antibiotici.[8]
Note
Bibliografia
- (EN) S. L. Buchwald, S. J. LaMaire, R. B. Nielsen, B. T. Watson e S. M. King, Schwartz's Reagent, in Org. Synth., vol. 71, 1993, pp. 77, DOI:10.15227/orgsyn.071.0077.
- (EN) D. W. Hart e J. Schwartz, Hydrozirconation. Organic synthesis via organozirconium intermediates. Synthesis and rearrangement of alkylzirconium(IV) complexes and their reaction with electrophiles, in J. Am. Chem. Soc., vol. 96, n. 26, 1974, pp. 8115–8116, DOI:10.1021/ja00833a048.
- (EN) C. G. Jones, M. Asay, L. J. Kim, J. F. Kleinsasser e altri, Characterization of Reactive Organometallic Species via MicroED, in ACS Cent. Sci., vol. 5, n. 9, 2019, pp. 1507–1513, DOI:10.1021/acscentsci.9b00403.
- (EN) M. W. Leighty, J. T. Spletstoser e G. I. Georg, Mild Conversion of Tertiary Amides to Aldehydes Using Cp2Zr(H)Cl (Schwartz's Reagent), in Org. Synth., vol. 88, 2011, pp. 427–437, DOI:10.1002/0471264229.os088.39.
- (EN) H. Li e P. J. Walsh, Catalytic Asymmetric Vinylation and Dienylation of Ketones, in J. Am. Chem. Soc., vol. 127, n. 33, 2005, pp. 8355–8361, DOI:10.1021/ja0425740.
- (EN) I. Marek (a cura di), Titanium and Zirconium in Organic Synthesis, Weinheim, Wiley-VCH, 2002, ISBN 3-527-30428-2.
- (EN) P. Meunier e N. Pirio, Zirconium & Hafnium: Organometallic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia264, ISBN 9780470862100.
- (EN) D. L. J. Pinheiro, P. P. de Castro e G. W. Amarante, Recent Developments and Synthetic Applications of Nucleophilic Zirconocene Complexes from Schwartz's Reagent, in Eur. J. Org. Chem., vol. 2018, n. 35, 2018, pp. 4828-4844, DOI:10.1002/ejoc.201800852.
- Sigma-Aldrich, Scheda di dati di sicurezza di Zirconocene chloride hydride, su sigmaaldrich.com, 2021. URL consultato l'11 aprile 2022.
- (EN) P. C. Wailes e H. Weigold, Hydrido complexes of zirconium I. Preparation, in J. Organomet. Chem., vol. 24, n. 2, 1970, pp. 405-411, DOI:10.1016/S0022-328X(00)80281-8.
- (EN) P. Wipf e H. Jahn, Synthetic Applications of organochlorozirconocene complexes, in Tetrahedron, vol. 52, n. 40, 1996, pp. 12853–12910, DOI:10.1016/0040-4020(96)00754-5.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Reattivo di Schwartz
Wikimedia Commons contiene immagini o altri file su Reattivo di Schwartz
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia