セレノシステイン
| セレノシステイン[1] | |
|---|---|
 | |
 | |
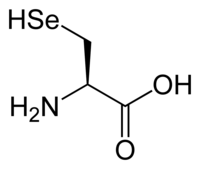
Selenocysteine | |
3-Selanyl-L-alanine (semisystematic name) 2-Amino-3-selanylpropanoic acid (fully systematic name) | |
別称 L-Selenocysteine; Selenium-cysteine | |
| 識別情報 | |
| CAS登録番号 | 3614-08-2  |
| PubChem | 25076 |
| ChemSpider | 23436  |
| UNII | 0CH9049VIS  |
| DrugBank | DB02345 |
| KEGG | C05688  |
| ChEBI |
|
| ChEMBL | CHEMBL109962  |
| |
| |
| 特性 | |
| 化学式 | C3H7NO2Se |
| モル質量 | 168.05 g mol−1 |
| 特性 | |
| 酸解離定数 pKa | 5.24,[2] 5.43[3] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
セレノシステイン (selenocysteine) はアミノ酸の一種である。3文字表記は Sec、1文字表記は U[4]。システインに似た構造を持つが、システインの硫黄 (S) がセレン (Se) に置き換わっている。セレノシステインを含むタンパク質はセレノプロテインと呼ばれる。
セレノシステインは、酸化・還元に関わるいくつかの酵素(グルタチオンペルオキシダーゼ、テトラヨードチロニン-5'-脱ヨウ素化酵素、チオレドキシン還元酵素、ギ酸デヒドロゲナーゼ、グリシン還元酵素や一部のヒドロゲナーゼなど)に存在する。
タンパク質に含まれる他のアミノ酸と違い、直接遺伝コードされているわけではない。セレノシステインは、普通はストップコドンとして使われるUGAコドンによって、特別の方法でコードされる。すなわち mRNA 中の UGAコドンはSecIS(SElenoCysteine Insertion Sequence、セレノシステイン挿入配列)がある場合にのみセレノシステインをコードする。SecISは特徴的なヌクレオチド配列と塩基対パターン(二次構造)で決められる。
真正細菌では SecIS は mRNA の翻訳領域内、目的とする UGAコドンのすぐ次に位置している。古細菌と真核生物では SecIS は mRNA の 3' 非翻訳領域にあり、複数の UGAコドンにセレノシステインをコードさせることができる。また古細菌では 5' 非翻訳領域に SecIS がある例が少なくとも1つ知られている。セレンがない場合には、セレノプロテインの翻訳は UGAコドンで終止し、短くて機能のないタンパク質ができる。
他のアミノ酸と同じくセレノシステインに対しては特有の tRNA がある。しかしセレノシステインtRNA (tRNA(Sec)) の一次・二次構造は標準的な tRNA といくつかの点で異なり、特に8塩基対(細菌)または9塩基対(真核生物)からなる acceptor stem、長い variable region arm、また他の tRNA ではよく保存されているいくつかの塩基における置換がある。
tRNA(Sec) は、まずセリルtRNA合成酵素によってセリンと結合されるが、これによってできる Ser-tRNA(Sec) は普通の翻訳伸長因子(細菌の EF-Tu、真核生物の EF1α)に認識されないため、翻訳に用いられない。その代わり tRNA に結合したセリン残基はセレノシステイン合成酵素(ピリドキサールリン酸を含む酵素)によってセレノシステイン残基に変換される。最後にこうしてできた Sec-tRNA(Sec) は特殊型の翻訳伸長因子(SelB または mSelB)に特異的に結合し、これはセレノプロテインの mRNA を翻訳中のリボソームを標的にして Sec-tRNA(Sec) を送り込む。この輸送は、セレノプロテイン mRNA内の SecIS のつくる RNA二次構造に結合するタンパク質中の特別のドメイン(細菌の SelB)、または、特別のサブユニット(真核生物mSelB の SBP-2)によって行われる。
出典
- ^ Merck Index, 12th Edition, 8584
- ^ Huber, R. E.; Criddle, R. S. (1967-10-01). “Comparison of the chemical properties of selenocysteine and selenocystine with their sulfur analogs”. Archives of Biochemistry and Biophysics 122 (1): 164–173. doi:10.1016/0003-9861(67)90136-1. ISSN 0003-9861. PMID 6076213. https://dx.doi.org/10.1016/0003-9861%2867%2990136-1.
- ^ Thapa, Bishnu; Schlegel, H. Bernhard (2016-11-10). “Theoretical Calculation of p K a 's of Selenols in Aqueous Solution Using an Implicit Solvation Model and Explicit Water Molecules” (英語). The Journal of Physical Chemistry A 120 (44): 8916–8922. Bibcode: 2016JPCA..120.8916T. doi:10.1021/acs.jpca.6b09520. ISSN 1089-5639. PMID 27748600. https://pubs.acs.org/doi/10.1021/acs.jpca.6b09520.
- ^ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature (1983年). 2008年10月9日時点のオリジナルよりアーカイブ。2018年3月5日閲覧。



