Bismut(III)fluoride
| Bismut(III)fluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
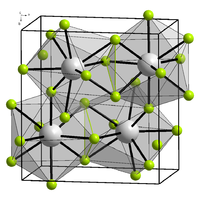 | ||||
De kristalstructuur van lijkt heel erg op die van het hier afgebeelde | ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Bismut(III)fluoride | |||
| Andere namen | Bismuttrifluoride | |||
| Molmassa | 265,9756 g/mol | |||
| SMILES | F-Bi(-F)-F | |||
| CAS-nummer | 7787-61-3 | |||
| EG-nummer | 232-124-8 | |||
| PubChem | 82233 | |||
| Wikidata | Q425248 | |||
| Beschrijving | Grijs-wit poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 -P264 -P280 -P301+P330+P331 -P303+P361+P353 -P304+P340 -P305+P351+P338 -P310 -P321 -P363 -P405 -P501 | |||
| EG-Index-nummer | 232-124-8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | grijs-wit | |||
| Dichtheid | 5,32 g/cm³ | |||
| Smeltpunt | 649 °C[1] | |||
| Onoplosbaar in | Water[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Bismut(III)fluoride is een anorganische verbinding van bismut en fluor, met als brutoformule . De stof is een grijs-wit poeder en onoplosbaar in water. Het komt in de natuur voor als het zeldzame mineraal gananiet.
Synthese
Bismut(III)fluoride wordt bereid uit bismut(III)oxide en waterstoffluoride volgens onderstaande reactie:
Structuur
komt in verschillende polymorfen voor. α- heeft een cubische kristalstructuur. Het is het prototype voor de D03-structuur, die voorkomt bij verschillende inter-metaalverbindingen zoals , , en [3] en het hydride .[4] De eenheidscel is een vlak gecentreerde kubus met bismut op de hoekpunten en de centrale vlak posities. Fluor bevindt zich op het midden van de zijden en in het midden van de acht sub-kubussen. Dat levert 4 bismut- en 12 fluor-atomen op.[5] De lengte van de zijde van de eenheidscel is 585,3 pm.[4][6] Algemeen wordt de structuur als ionogeen beschouwd, dit in tegenstelling met de lichtere verbindingen uit deze groep, waarin ook in de vaste toestand nog duidelijk -eenheden herkenbaar zijn.[6]
Reacties
wordt niet door water aangetast, maar is daar ook nauwelijks in oplosbaar. Complexen en adducten worden niet makkelijk gevormd, al zijn er wel aan paar bekend: en het ion is bekend uit . De additie-verbinding hydrolyseert in water tot bismutoxyfluoride .[7]
Toepassingen
heeft in de research de aandacht getrokken als een mogelijk elektrodematriaal in Lithium-ion-accu
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Bismuth trifluoride op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Greenwood&Earnshaw
- ↑ Gearchiveerde kopie. Gearchiveerd op 19 juli 2011. Geraadpleegd op 13 februari 2024.
- ↑ The Structure of Materials. Cambridge University Press (2012), "Appendix 1. Crystal Structure Descriptions".
- ↑ a b Galasso, Francis S. (1970). Structure and Properties of Inorganic Solids: International Series of Monographs in Solid State Physics (Pergammon Press).
- ↑ Sólyom, Jenö (2007). Fundamentals of the Physics of Solids: Volume 1: Structure and Dynamics, p. 220. ISBN 978-3-540-72599-2.
- ↑ a b Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth. Springer, pp. 88. ISBN 978-0-7514-0389-3.
















![{\displaystyle {\ce {( \ [BiO]F \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18179f42264183d23f53772b21e0fecca2f4374d)











