Termodynamisk beta
I statistisk termodynamikk er termodynamisk beta, også kjent som kulde, resiprok av den termodynamiske temperaturen til et system:
- [1]
Hvor:
- er temperaturen
- er Boltzmanns konstant
Den ble opprinnelig introdusert i 1971 (som Kältefunktion "kaldhetsfunksjon") av Ingo Müller, en av forkjemperne for den rasjonelle tankegang,[2] basert på tidligere forslag om en "gjensidig temperatur" -funksjon.[3][4]
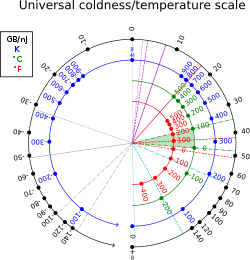
Termodynamisk beta har enheter resiprok med energien (i SI-enhet, resiprokjoule, ). I ikke-termiske enheter kan den også måles i byte per joule, eller mer praktisk, gigabyte per nanojoule;[5] 1 K−1 tilsvarer omtrent 13 062 gigabyte per nanojoule; i romtemperatur: T = 300K, β ≈ 44 GB/nJ ≈ 39 eV−1 ≈ 2,4×1020 J−1. Konverteringsfaktoren er 1 GB/nJ = J−1.
Beskrivelse
Termodynamisk beta er egentlig forbindelsen mellom informasjonsteorien og statistisk mekanikkfortolkning av et fysisk system gjennom dets entropi og termodynamikken knyttet til energien. Det uttrykker entropiens respons på en økning i energi. Hvis et system utfordres med en liten mengde energi, beskriver β mengden systemet vil randomisere.
Via den statistiske definisjonen av temperatur som en funksjon av entropi, kan kuldefunksjonen beregnes i det mikrokanoniske ensemblet fra formelen
(dvs. delvis derivat av entropien S med hensyn til energien E ved konstant volum V og partikkelnummer N).
Fordeler
Selv om β er fullstendig ekvivalent i konseptuelt innhold med temperatur, anses β generelt som en mer grunnleggende mengde enn temperatur på grunn av fenomenet negativ temperatur, der β er kontinuerlig når den krysser null, mens T har en egenart.[6]
I tillegg har β fordelen av å være lettere å forstå årsaksvis: Hvis en liten mengde varme tilsettes et system, er β økningen i entropi delt på økningen i varme. Temperatur er vanskelig å tolke i samme forstand, da det ikke er mulig å "legge til entropi" til et system bortsett fra indirekte, ved å modifisere andre størrelser som temperatur, volum eller antall partikler.
Statistisk tolkning
Fra et statistisk synspunkt er β en numerisk størrelse som relaterer to makroskopiske systemer i likevekt. Den eksakte formuleringen er som følger. Tenk på to systemer, 1 og 2, i termokontakt, med respektive energier E1 og E2. Vi antar at E1 + E2 =konstant E. Antall mikrotilstander i hvert system vil bli betegnet med Ω1 og Ω2. Under våre antakelser avhenger Ωi bare av Ei. Vi antar også at en hvilken som helst mikrotilstand i system 1 som er i samsvar med E1 kan eksistere sammen med hvilken som helst mikrotilstand i system 2 som er i samsvar med E2. Dermed er antallet mikrotilstander for det kombinerte systemet
Vi vil utlede β fra den grunnleggende antagelsen om statistisk mekanikk:
- Når det kombinerte systemet når likevekt, maksimeres tallet Ω.
(Med andre ord søker systemet naturlig nok det maksimale antallet mikrostater.) Derfor, ved likevekt,
Men E1 + E2 = E tilsier
Så
det vil si
Ovennevnte forhold motiverer en definisjon av β:
Forbindelse av statistisk visning med termodynamisk utsikt
Når to systemer er i likevekt, har de samme termodynamisk temperatur T . Dermed ville man intuitivt forvente at β (som definert via mikrotilstander) på en eller annen måte var relatert til T. Denne lenken er gitt av Boltzmanns grunnleggende antagelse skrevet som
hvor kB er Boltzmann-konstanten, S er den klassiske termodynamiske entropien, og Ω er antallet mikrotilstander. Så
Å erstatte definisjonen av β fra den statistiske definisjonen ovenfor gir
Sammenligning med termodynamisk formel
vi har
hvor kalles systemets grunntemperatur, og har energienheter.
Referanser
- ^ Meixner, J. (1. september 1975). «Coldness and temperature». Archive for Rational Mechanics and Analysis. 3 (engelsk). 57: 281–290. ISSN 1432-0673. doi:10.1007/BF00280159. Besøkt 3. februar 2021.
- ^ I. Müller (1971). «Die Kältefunktion, eine universelle Funktion in der Thermodynamik wärmeleitender Flüssigkeiten». Archive for Rational Mechanics and Analysis. 40: 1–36.
- ^ Day, W.A. og Gurtin, Morton. «On the symmetry of the conductivity tensor and other restrictions in the nonlinear theory of heat conduction». Archive for Rational Mechanics and Analysis. 33: 26–32.
- ^ Castle, W. Emmenish, R. Henkes, R. Miller, og J. Rayne (1965). «Temperature from Zero to Zero». Science by Degrees. New York: Walker and Company – via Westinghouse Search Book Series.
- ^ P. Fraundorf (2003) "Heat capacity in bits", Amer. J. Phys. 71:11, 1142-1151.
- ^ Kittel, Charles. (1969). Thermal physics. New York,: Wiley. ISBN 0-471-49030-X. OCLC 27371.



![{\displaystyle [\beta ]={\textrm {J}}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/95d75d6e2e60e9f106f17e91bd18a413a3a9d6e9)























