Inden (związek chemiczny)
 | Ten artykuł dotyczy związku chemicznego. Zobacz też: inne znaczenia tego słowa. |
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny | C9H8 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 116,16 g/mol | ||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz[3] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | 95-13-6 | ||||||||||||||||||||||||||||
| PubChem | 7219 | ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Pochodne | indan, 2-indanol, 4-indanol, 5-indanol | ||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Inden, 1H-inden, C
9H
8 – organiczny związek chemiczny, bicykliczny węglowodór aromatyczny[4][5] o dwóch skondensowanych pierścieniach: benzenowym i cyklopentadienowym. Jego izomerem jest 2H-inden (izoinden)[8].
-
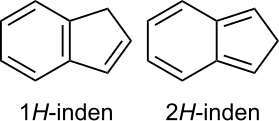 Budowa indenu (1H-indenu) i izoindenu (2H-indenu)
Budowa indenu (1H-indenu) i izoindenu (2H-indenu)
Otrzymywanie
Występuje w smole pogazowej (został w niej odkryty w 1890 roku[9]) i pozostałościach po produkcji olefin. Można go wyizolować poprzez destylację ekstrakcyjną używając N-metylo-2-pirolidonu lub przez destylację rektyfikacyjną i krystalizację z półproduktu, z którego usunięto wcześniej fenol za pomocą ekstrakcji roztworem NaOH. Opracowano też technologię, w której fenolu nie usuwa się, lecz wykorzystuje jego obecność do destylacji azeotropowej układu inden-fenol. Po dodaniu wody fenol przechodzi do dolnej fazy wodnej, a czysty inden znajduje się w fazie górnej[9].
Wysokiej czystości inden uzyskać można przeprowadzając go w indenek sodu w atmosferze obojętnej. Nieprzereagowane zanieczyszczenia usuwa się przez odparowanie pod zmniejszonym ciśnieniem, a następnie inden odzyskuje się, hydrolizując indenek sodu wodą. Czysty produkt izoluje się przez destylację z parą wodną i destylację frakcyjną[10][11].
Właściwości chemiczne
Łatwo polimeryzuje, już w temperaturze pokojowej i w ciemności. Proces ten przyspieszają katalizatory reakcji Friedla-Craftsa, kwasy i podgrzanie[9].
Wykazuje właściwości kwasowe, jego pKa wynosi 18–23[5]. Reaguje z sodem[12] i amidkiem sodu[13][10] dając indenek sodu (zwany też indenylosodem) o budowie jonowej[12]. Podobnie jak cyklopentadien, benzocyklopentadien tworzy związki metaloorganiczne, np. FeIn
2, RuIn
2, LnIn
2 i LnIn
3 (gdzie In – indenyl, Ln – lantanowiec) i inne kompleksy z metalami przejściowymi[14]. W przeciwieństwie do anionu cyklopentadienylowego, o w pełni zdelokalizowanym ładunku, ładunek ujemny anionu In−
zlokalizowany jest głównie w pozycjach benzylowych. Dla kompleksu z cerem, dane analityczne wskazują na możliwość występowania wiązania kowalencyjnego Ce–C1[12].
Zastosowanie
Stosowany jest do produkcji żywic indenowo-kumaronowych i węglowodorowych oraz do otrzymywania indanu i jego pochodnych[9][15].
Przypisy
- ↑ a b P-25.1.1 Zachowane nazwy węglowodorów używanych jako macierzyste składniki pierścieniowe i jako przyłączone składniki pierścieniowe, [w:] Henri A.H.A. Favre Henri A.H.A., Warren H.W.H. Powell Warren H.W.H., Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013, Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), wyd. 5, Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej, [2023], s. 195 .
- ↑ a b c David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 3-302, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c Indene, [w:] PubChem [online], United States National Library of Medicine, CID: 7219 [dostęp 2021-12-29] (ang.).
- ↑ a b Robert A.R.A. Moss Robert A.R.A., Matthew S.M.S. Platz Matthew S.M.S., MaitlandM. Jones MaitlandM., jr. (red.), Reactive Intermediate Chemistry, Hoboken: John Wiley & Sons, 24 grudnia 2003, DOI: 10.1002/0471721492, ISBN 978-0-471-72149-9 (ang.).
- ↑ a b c Evgenij TrofimovičE.T. Denisov Evgenij TrofimovičE.T., Oleg MO.M. Sarkisov Oleg MO.M., Gerts IlʹichG.I. Likhtenshtein Gerts IlʹichG.I., Chemical Kinetics. Fundamentals and Recent Developments, Elsevier Science, s. 434, DOI: 10.1016/B978-0-444-50938-3.X5021-2, ISBN 978-0-444-50938-3 (ang.).
- ↑ a b Indene, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2013-03-17] (ang.).
- ↑ a b c d Indene [online], karta charakterystyki produktu Sigma-Aldrich, 26 października 2019, numer katalogowy: 193828 [dostęp 2022-06-29] . (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 2-18, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c d KarlK. Griesbaum KarlK. i inni, Hydrocarbons, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 43–44, DOI: 10.1002/14356007.a13_227 (ang.).
- ↑ a b Glen A.G.A. Russell Glen A.G.A., Oxidation of Unsaturated Compunds. IV. Kinetics of the Reaction of Indene with Oxygen; Evidence of the Identity of Active Intermediates in Thermal and Catalyzed Oxidations, „Journal of the American Chemical Society”, 78 (5), 1956, s. 1041–1044, DOI: 10.1021/ja01586a045 (ang.).
- ↑ Indene, [w:] Wilfred L.F.W.L.F. Armarego Wilfred L.F.W.L.F., Christina Li LinCh.L.L. Chai Christina Li LinCh.L.L., Purification of Laboratory Chemicals, Elsevier, 2009, s. 301, DOI: 10.1016/c2009-0-26589-5, ISBN 978-1-85617-567-8 (ang.).
- ↑ a b c MinoruM. Tsutsui MinoruM., H.J.H.J. Gysling H.J.H.J., New series of organolanthanides: Ln(indenyl), „Journal of the American Chemical Society”, 91 (12), 1969, s. 3175–3178, DOI: 10.1021/ja01040a013 (ang.).
- ↑ R.R. Weißgerber R.R., Über eine Natriumverbindung des Indens, „Berichte der deutschen chemischen Gesellschaft”, 42 (1), 1909, s. 569–572, DOI: 10.1002/cber.19090420189 (niem.).
- ↑ Joseph M.J.M. O’Connor Joseph M.J.M., Charles P.Ch.P. Casey Charles P.Ch.P., Ring-slippage chemistry of transition metal cyclopentadienyl and indenyl complexes, „Chemical Reviews”, 87 (2), 1987, s. 307–318, DOI: 10.1021/cr00078a002 (ang.).
- ↑ HardoH. Siegel HardoH., ManfredM. Eggersdorfer ManfredM., Resins, Synthetic, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 16, ISBN 978-3-527-30385-4 (ang.).
- GND: 4161475-6
- БРЭ: 2008553











