BAR domen
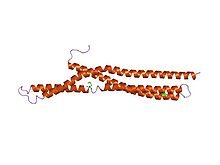 | |||||||||
| Struktura amfifizinskog BAR.[1] | |||||||||
| Identifikatori | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Simbol | BAR | ||||||||
| Pfam | PF03114 | ||||||||
| InterPro | IPR004148 | ||||||||
| SMART | SM00721 | ||||||||
| PROSITE | PDOC51021 | ||||||||
| SCOP | 1uru | ||||||||
| Superfamilija | 1uru | ||||||||
| CDD | cd07307 | ||||||||
| |||||||||
BAR (Bin–Amfifizin–Rvs) domeni su visoko konzervirani proteinski dimerizacioni domeni koji se javljaju u mnogim proteinima, i koji učestvuju u membranskoj dinamici ćelije. BAR domen ima oblik banane i vezuje se za membranu putem svoje konkavne površine. On ima sposobnost detektovanja membranske zakrivljenosti putem preferentnog vezivanja za zakrivljene membrane.
BAR domeni se javljaju u kombinaciji sa drugim domenima
Mnogi proteini BAR familije sadrže alternativne domene lipidne specifičnosti koji pomažu u selektivnom vezivanju određenih membranskih sekcija. Neki takođe imaju SH3 domene za koje se vezuje dinamin, te su proteini poput amfifizina i endofilina implicirani u orkestraciju odvajanja vezikula.
Ljudski proteini koji sadrže ovaj domen
AMPH; ARHGAP17; BIN1; BIN2; BIN3; DNMBP; GMIP; RICH2; SH3BP1; SH3GL1; SH3GL2; SH3GL3; SH3GLB1; SH3GLB2;
Reference
- ↑ Peter BJ, Kent HM, Mills IG, et al. (January 2004). „BAR domains as sensors of membrane curvature: the amphiphysin BAR structure”. Science 303 (5657): 495–9. DOI:10.1126/science.1092586. PMID 14645856.
Literatura
- Leventis PA, Chow BM, Stewart BA, Iyengar B, Campos AR, Boulianne GL (November 2001). „Drosophila Amphiphysin is a post-synaptic protein required for normal locomotion but not endocytosis”. Traffic 2 (11): 839–50. DOI:10.1034/j.1600-0854.2001.21113.x. PMID 11733051. Arhivirano iz originala na datum 2013-01-18. Pristupljeno 2014-05-16.
- Zhang B, Zelhof AC (July 2002). „Amphiphysins: raising the BAR for synaptic vesicle recycling and membrane dynamics. Bin-Amphiphysin-Rvsp”. Traffic 3 (7): 452–60. DOI:10.1034/j.1600-0854.2002.30702.x. PMID 12047553. Arhivirano iz originala na datum 2013-01-18. Pristupljeno 2014-05-16. Review.
- Zelhof AC, Bao H, Hardy RW, Razzaq A, Zhang B, Doe CQ (December 2001). „Drosophila Amphiphysin is implicated in protein localization and membrane morphogenesis but not in synaptic vesicle endocytosis”. Development 128 (24): 5005–15. PMID 11748137.
- Mathew D, Popescu A, Budnik V (November 2003). „Drosophila amphiphysin functions during synaptic Fasciclin II membrane cycling”. J. Neurosci. 23 (33): 10710–6. PMID 14627656.
- Peter BJ, Kent HM, Mills IG, et al. (January 2004). „BAR domains as sensors of membrane curvature: the amphiphysin BAR structure”. Science 303 (5657): 495–9. DOI:10.1126/science.1092586. PMID 14645856.
- Weissenhorn W (August 2005). „Crystal structure of the endophilin-A1 BAR domain”. J. Mol. Biol. 351 (3): 653–61. DOI:10.1016/j.jmb.2005.06.013. PMID 16023669.
- Gallop JL, Jao CC, Kent HM, et al. (June 2006). „Mechanism of endophilin N-BAR domain-mediated membrane curvature”. EMBO J. 25 (12): 2898–910. DOI:10.1038/sj.emboj.7601174. PMC 1500843. PMID 16763559.
- Masuda M, Takeda S, Sone M, et al. (June 2006). „Endophilin BAR domain drives membrane curvature by two newly identified structure-based mechanisms”. EMBO J. 25 (12): 2889–97. DOI:10.1038/sj.emboj.7601176. PMC 1500852. PMID 16763557.
- Frost A, Perera R, Roux A, et al. (March 2008). „Structural basis of membrane invagination by F-BAR domains”. Cell 132 (5): 807–17. DOI:10.1016/j.cell.2007.12.041. PMC 2384079. PMID 18329367.
Povezano
- Epsin
Spoljašnje veze
- Structure of a BAR module Arhivirano 2013-07-27 na Wayback Machine-u





