SHH
| SHH | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
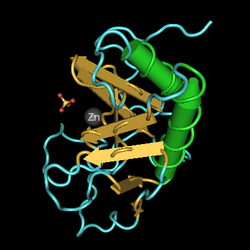 | |||||||||||||||||
| |||||||||||||||||
| Ідентифікатори | |||||||||||||||||
| Символи | SHH, HHG1, HLP3, HPE3, MCOPCB5, SMMCI, TPT, TPTPS, sonic hedgehog, Sonic hedgehog, ShhNC, sonic hedgehog signaling molecule | ||||||||||||||||
| Зовнішні ІД | OMIM: 600725 MGI: 98297 HomoloGene: 30961 GeneCards: SHH | ||||||||||||||||
| Пов'язані генетичні захворювання | |||||||||||||||||
| holoprosencephaly 3, Laurin-Sandrow syndrome[1] | |||||||||||||||||
| |||||||||||||||||
| Шаблон експресії | |||||||||||||||||
 | |||||||||||||||||
| Більше даних | |||||||||||||||||
| Ортологи | |||||||||||||||||
| Види | Людина | Миша | |||||||||||||||
| Entrez |
|
| |||||||||||||||
| Ensembl |
|
| |||||||||||||||
| UniProt |
|
| |||||||||||||||
| RefSeq (мРНК) |
|
| |||||||||||||||
| RefSeq (білок) |
|
| |||||||||||||||
| Локус (UCSC) | Хр. 7: 155.8 – 155.81 Mb | Хр. 5: 28.66 – 28.67 Mb | |||||||||||||||
| PubMed search | [2] | [3] | |||||||||||||||
| Вікідані | |||||||||||||||||
| |||||||||||||||||
Sonic hedgehog (SHH) — це один з трьох білків сигнальної трансдукції ссавців, а також ген, що його кодує. Інші два — desert hedgehog (DHH) та Indian hedgehog (IHH). Всіх їх називають hh-гомологи. SHH є найкраще вивченим лігандом сигнальної трансдукції. Він відіграє ключову роль у регулюванні органогенезу хребетних, наприклад, в утворенні пальців на кінцівках та формуванні мозку. Sonic hedgehog — найкращий приклад морфогену, який визначається моделлю трикольорового прапору Льюїса Вольперта — молекули, яка дифундує, утворюючи градієнт концентрації та має різний вплив на клітини розвиваючогося ембріона в залежності від його концентрації. SHH залишається важливим білком у організмі дорослої людини. Він контролює клітинний поділ дорослих стовбурових клітин і бере участь у розвитку деяких видів раку.
Sonic hedgehog — білок, який кодується однойменним геном, розташованим у людей на короткому плечі 7-ї хромосоми.[4] Як білок, так і ген, що цього кодує, можна також позначати абревіатурою Shh
Довжина поліпептидного ланцюга білка становить 462 амінокислот, а молекулярна маса — 49 607[5].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MLLLARCLLL | VLVSSLLVCS | GLACGPGRGF | GKRRHPKKLT | PLAYKQFIPN | ||||
| VAEKTLGASG | RYEGKISRNS | ERFKELTPNY | NPDIIFKDEE | NTGADRLMTQ | ||||
| RCKDKLNALA | ISVMNQWPGV | KLRVTEGWDE | DGHHSEESLH | YEGRAVDITT | ||||
| SDRDRSKYGM | LARLAVEAGF | DWVYYESKAH | IHCSVKAENS | VAAKSGGCFP | ||||
| GSATVHLEQG | GTKLVKDLSP | GDRVLAADDQ | GRLLYSDFLT | FLDRDDGAKK | ||||
| VFYVIETREP | RERLLLTAAH | LLFVAPHNDS | ATGEPEASSG | SGPPSGGALG | ||||
| PRALFASRVR | PGQRVYVVAE | RDGDRRLLPA | AVHSVTLSEE | AAGAYAPLTA | ||||
| QGTILINRVL | ASCYAVIEEH | SWAHRAFAPF | RLAHALLAAL | APARTDRGGD | ||||
| SGGGDRGGGG | GRVALTAPGA | ADAPGAGATA | GIHWYSQLLY | QIGTWLLDSE | ||||
| ALHPLGMAVK | SS |
Кодований геном білок за функціями належить до гідролаз, протеаз, білків розвитку. Білок має сайт для зв'язування з іонами металів, іоном цинку, іоном кальцію. Локалізований у клітинній мембрані. Також секретований назовні.
Відкриття та назва
Ген sonic hedgehog (hh) вперше був ідентифікований у плодової мушки Drosophila melanogaster вченими англ. Christiane Nüsslein-Volhard та англ. Eric Wieschaus, та опублікований в 1980 році. [6], за що вони отримали Нобелівську премію в 1995 році разом з генетиком Едвардом Б. Льюїсом, який визначив гени, що контролюють патерни сегментації ембріонів дрозофіли. Втрата функціонування hh у мутантного фенотипу призводить до того, що ембріони покриваються зубцями, невеликими точковими виступами, що нагадують голки їжака.
Дослідження, спрямовані на пошук еквівалента sonic hedgehog у хребетних, проведені Філіпом Інгегом, Ендрю П. МакМахоном та Кліффордом Табіном, показали три подібні гени. [7][8][9][10] Два з них, desert hedgehog та Indian hedgehog — були названі на честь видів їжаків, а sonic hedgehog був названий на честь популярного в той час персонажа відеогри SEGA, їжака Соніка. [11][12] Назва була обрана Робертом Ріддлом, постдоктором лабораторії Tabin, після того, як він побачив комікс з даним персонажем, зроблений його дочкою з Англії. [13][14]
Функції
З hh-гомологів було виявлено, що SHH має найважливішу роль у розвитку, виступаючи в ролі морфогену, що залучає до складання множинних систем, включаючи кінцівку [9] та серединну структуру головного мозку, [15][16] спинного мозку,[17] Таламусу в zona limitans intrathalamica, [18][19] легенів, [20] і зубів. [21]
Мутації в гені SHH людини, викликають голопрозенцефалію третього типу внаслідок втрати вентральної середньої лінії. SHH виділяється в зоні поляризаційної активності[en], яка розташована на задній стороні долоні кінцівок у ембріоні. Шлях транскрипції SHH також був пов'язаний з утворенням специфічних видів ракових пухлин, у тому числі ембріональної пухлини мозочка [22] та медулобластоми [23], а також прогресуванням пухлин раку передміхурової залози [24]. Для того, щоб SHH був виражений у кінцівках ембріонів, що розвиваються, морфоген, що називається фактором росту фібробластів, повинен виділятися з верхівкового ектодермального гребеню[en].[25]

SHH також показав, що він діє як аксональний навідник[en]. Показано, що SHH направляє комісулярні аксони на вентральну середню лінію спинного мозку, що розвивається. [26] Зокрема, SHH притягує аксони нейронів гангліїв сітківки (RGC) у низьких концентраціях і відштовхує їх у більш високих концентраціях. [27] Показано, що відсутність SHH забезпечує зародження недорозвинених задніх кінцівок у китоподібних [28] (кити та дельфіни).
Формування центральної нервової системи
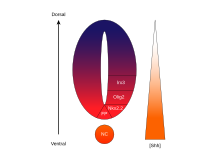
Молекула сигнального білку Sonic hedgehog (SHH) відіграє різні ролі при формуванні центральної нервової системи (ЦНС) під час розвитку хребетних. Одним з найбільш характерних функцій SSH є його роль у індукції вентральної пластинки[en] та різноманітних типів вентральних клітин у нервовій трубці [29]. Хорда, структура, сформована з осьової мезодерми, виробляє SHH, який міжклітинно проходить до вентральної ділянки нервової трубки, і сигналізує цим клітинам утворювати вентральну пластинку. [30] Інша точка зору щодо індукції вентральної пластинки припускає, що деякі клітини-попередники, розташовані в хорді, мігрують в нервову пластину до її утворення, згодом породжуючи вентральну пластинку[31].
Сама нервова трубка є попередником хребетної ЦНС, а вентральна пластинка є спеціалізованою структурою і розташована у середній точці нейронної трубки. Докази, що підтверджують діяльність хорди як центру сигналізації походять від досліджень, в яких другий нотохорд імплантується поблизу нервової трубки in vivo, що призводить до утворення вентральної пластинки в межах нервової трубки [32].
SHH - це протеїн, який опосередковує сигнальну діяльність нотохорду та поверальної пластинки. [33] Дослідження, що вивчають експресію SHH in vitro [34] та in vivo [35], проказують, що вона призводить до індукції вентральної пластинки та диференціювання моторних нейронів та вентральних інтернейронів. З іншого боку, мишей-мутантів по SHH відсутні вентральні характеристики спинного мозку [36]. In vitro блокування SHH сигналізації з використанням антитіл проти нього проявляє подібні фенотипи [35] SHH exerts its effects in a concentration-dependent manner,[37]. Вплив SHH має залежність від концентрації, тому висока концентрація SHH призводить до локального гальмування клітинної проліферації [38]. Це пригнічення призводить до того, що вентральна пластинка стає тонкою в порівнянні з латеральними областями нервової трубки. Зниження концентрації SHH призводить до проліферації клітин та індукції різних типів вентральних нейронних клітин. Після того, як сформовано вентральну пластинку[en], клітини, що знаходяться у цьому регіоні, згодом експресують SHH [35], що генерує градієнт концентрації в нервовій трубці [38].
Морфогенетична активність
Концентрація та залежна від часу детермінуюча активність SHH у вентральній нервовій трубці, робить його головним прикладом морфогену. У хребетних сигналізація SHH у вентральній частині нейронної трубки найчастіше відповідальна за індукцію вентральної пластинки[en] клітин та моторних нейронів.[39] SHH виходить з хорди та вентральної пластинки нервової трубки, що розвивається, щоб створити градієнт концентрації, який охоплює дорзо-вентральну вісь [40]. Більш високі концентрації ліганду SHH зустрічаються найбільш вентральних частинах нервової трубки і хорди, в той час як менші концентрації зустрічаються в більш дорсальних ділянках нервової трубки [40]. Градієнт концентрації SHH був візуалізований у нервовій трубці мишей, модифікованих для експресії комплексу білків SHH — GFP, щоб візуалізувати цей градуйований розподіл SHH під час формування вентральної нервової трубки.[41]
Формування зубів
SHH - сигнальна молекула, кодована однойменним геном. SHH відіграє дуже важливу роль в органогенезі і, головне, розвитку черепно-лицьового відділу. SHH є сигнальною молекулою, що в першу чергу дифундує вздовж градієнта концентрації, що чинить різний вплив на віддалені одна відносно одної клітини. У ранньому розвитку зубів SHH вивільняється з первинного емалевого вузла[en], сигнального центру, що забезпечує позиційну інформацію у розвитку зубів та регуляції росту зуба [42]. Зокрема, SHH необхідний для росту епітеліальних шийних петель, де зовнішні та внутрішні епітелії приєднуються і утворюють резервуар для стовбурових клітин пульпи зуба. Після того як первинні емалеві вузли апоптозуються, утворюються вторинні емалеві вузли. Первинні емалеві вузли виділяють SHH у поєднанні з іншими сигнальними молекулами, щоб згущати оральний ектодерм і починати формувати складні форми коронки зуба під час диференціації та мінералізації [43]. В моделі нокаутного гена відсутність SHH свідчить про голопросенцефалію. Крім того, SHH активує молекули Gli2 і Gli3. Мутантні ембріони по Gli2 та Gli3 мають ненормальний розвиток різців, а також дрібних молярів [44].
Процесинг
SHH проходить ряд етапів обробки, перш ніж він виділяється з клітини. Щойно синтезований SHH важить 45 кДа. Він містить коротку сигнальну послідовність[en] на її N-кінці, яка визнає розпізнавання білку під час транслокації в ендоплазматичний ретикулум. Після завершення транслокації сигнальна послідовність видаляється сигнальною пептидазою в ендоплазматичному ретикулумі. Там SHH проходить автопроцесинг і генерує N-кінцевий сигнальний домен 20 кДа (SHH-N) і 25-кДа C-кінцевий сигнальний домен невідомого призначення.[45] Розщеплення каталізується протеазою в межах С-кінцевого домену. Під час реакції розщеплення молекула холестеролу приєднується до С-кінця SHH-N.[46][47] Таким чином, C-кінцевий домен діє як інтеїн та холестеролова трансфераза.

Інший гідрофобний фрагмент, пальмітат, приєднується до альфа-аміну N-кінцевого цистеїну SHH-N. Ця модифікація необхідна для ефективної сигналізації, і приводить до 30-кратного збільшення потенції над непальмітильованою формою і виконується Protein-cysteine N-palmitoyltransferase, членом сімейства мембран-ассоційованих О-ацетилтрансфераз[en]. [48]
Роботнікінін
Потенційний інгібітор SHH сигналіхації отримав назву роботнікінін, на честь героя-антагоніста Sonic The Hedgehog, Доктора Айво Роботніка.[49]
Суперечка щодо назви
Ген sonic hedgehog пов'язаний з патологією голопрозенцефалією, яка призводить до серйозних дефектів головного мозку, черепа та обличчя. Цей факт закликає клініцистів та вчених критикувати назву на підставі того, що в такому контексті вона звучить надто легковажно. Ще менш комічна ситуація виникає коли пацієнтам або батькам пацієнтів з серйозним розладом сповіщають, що вони або їхні діти мають мутацію у гені "Sonic Hedgehog", названому ім'ям персонажу дитячої відеогри. [13][50][51]
Галерея
 |
 |  |  |
Література
- Norbnop P., Srichomthong C., Suphapeetiporn K., Shotelersuk V. (2014). ZRS 406A>G mutation in patients with tibial hypoplasia, polydactyly and triphalangeal first fingers. J. Hum. Genet. 59: 467—470. PMID 24965254 DOI:10.1038/jhg.2014.50
- El-Jaick K.B., Brunoni D., Castilla E.E., Moreira M.A., Orioli I.M. (2005). SHH Ile111Asp in alobar holoprosencephaly in a proposita, whose mother had only a solitary median maxillary incisor. Am. J. Med. Genet. A. 136: 345—345. PMID 15942952 DOI:10.1002/ajmg.a.30624
- Ribeiro L.A., Richieri-Costa A. (2005). Single median maxillary central incisor, hypophyseal tumor, and SHH mutation. Am. J. Med. Genet. A. 136: 346—347. PMID 15942953 DOI:10.1002/ajmg.a.30625
- Maity T., Fuse N., Beachy P.A. (2005). Molecular mechanisms of Sonic hedgehog mutant effects in holoprosencephaly. Proc. Natl. Acad. Sci. U.S.A. 102: 17026—17031. PMID 16282375 DOI:10.1073/pnas.0507848102
- Richieri-Costa A., Ribeiro L.A. (2006). Holoprosencephaly-like phenotype: clinical and genetic perspectives. Am. J. Med. Genet. A. 140: 2587—2593. PMID 17001669 DOI:10.1002/ajmg.a.31378
- Tate G., Kishimoto K., Mitsuya T. (2000). Expression of Sonic hedgehog and its receptor Patched/Smoothened in human cancer cell lines and embryonic organs. J. Biochem. Mol. Biol. Biophys. 4: 27—34.
Примітки
- ↑ Захворювання, генетично пов'язані з SHH переглянути/редагувати посилання на ВікіДаних.
- ↑ Human PubMed Reference:.
- ↑ Mouse PubMed Reference:.
- ↑ HUGO Gene Nomenclature Commitee, HGNC:10848 (англ.) . Архів оригіналу за 23 вересня 2017. Процитовано 7 вересня 2017.
- ↑ UniProt, Q15465 (англ.) . Архів оригіналу за 21 вересня 2017. Процитовано 7 вересня 2017.
- ↑ Nüsslein-Volhard C, Wieschaus E (October 1980). Mutations affecting segment number and polarity in Drosophila. Nature. 287 (5785): 795—801. doi:10.1038/287795a0. PMID 6776413.
{{cite journal}}:|url-access=вимагає|url=(довідка) - ↑ Krauss S, Concordet JP, Ingham PW (December 1993). A functionally conserved homolog of the Drosophila segment polarity gene hh is expressed in tissues with polarizing activity in zebrafish embryos. Cell. 75 (7): 1431—44. doi:10.1016/0092-8674(93)90628-4. PMID 8269519.
{{cite journal}}:|url-access=вимагає|url=(довідка) - ↑ Echelard Y, Epstein DJ, St-Jacques B, Shen L, Mohler J, McMahon JA, McMahon AP (December 1993). Sonic hedgehog, a member of a family of putative signaling molecules, is implicated in the regulation of CNS polarity. Cell. 75 (7): 1417—30. doi:10.1016/0092-8674(93)90627-3. PMID 7916661.
- ↑ а б Riddle RD, Johnson RL, Laufer E, Tabin C (1993). Sonic hedgehog mediates the polarizing activity of the ZPA. Cell. 75 (7): 1401—16. doi:10.1016/0092-8674(93)90626-2. PMID 8269518.
- ↑ Angier N (11 січня 1994). Biologists Find Key Genes That Shape Patterning of Embryos. Science. New York Times. Архів оригіналу за 17 серпня 2017. Процитовано 14 січня 2018.
- ↑ Anwood R (6 вересня 2007). Emus Can't Walk Backwards. Ebury Press. с. 113—114. ISBN 978-0-09-192151-4. Архів оригіналу за 7 травня 2017. Процитовано 14 січня 2018.
- ↑ Tom Simonite (15 грудня 2005). Pokémon blocks gene name. Т. 438, № 897. Nature. doi:10.1038/438897a. Архів оригіналу за 31 жовтня 2010. Процитовано 23 травня 2013.
- ↑ а б A Gene Named Sonic. The New York Times. 11 січня 1994. Архів оригіналу за 28 лютого 2018. Процитовано 14 січня 2018.
- ↑ Annalise Keen & Cliff Tabin (12 квітня 2004). Cliff Tabin: Super Sonic An Interview. The Weekly Murmur. Архів оригіналу за 10 листопада 2005. Процитовано 14 січня 2018.
- ↑ Herzog W, Zeng X, Lele Z, Sonntag C, Ting JW, Chang CY, Hammerschmidt M (February 2003). Adenohypophysis formation in the zebrafish and its dependence on sonic hedgehog. Dev. Biol. 254 (1): 36—49. doi:10.1016/S0012-1606(02)00124-0. PMID 12606280.
- ↑ Rash BG, Grove EA (Oct 2007). Patterning the dorsal telencephalon: a role for sonic hedgehog?. The Journal of Neuroscience. 27 (43): 11595—603. doi:10.1523/JNEUROSCI.3204-07.2007. PMID 17959802.
- ↑ Lewis KE, Eisen JS (September 2001). Hedgehog signaling is required for primary motoneuron induction in zebrafish. Development. 128 (18): 3485—95. PMID 11566854.
- ↑ Scholpp S, Wolf O, Brand M, Lumsden A (March 2006). Hedgehog signalling from the zona limitans intrathalamica orchestrates patterning of the zebrafish diencephalon. Development. 133 (5): 855—64. doi:10.1242/dev.02248. PMID 16452095.
- ↑ Rash BG, Grove EA (Nov 2011). Shh and Gli3 regulate formation of the telencephalic-diencephalic junction and suppress an isthmus-like signaling source in the forebrain. Developmental Biology. 359 (2): 242—50. doi:10.1016/j.ydbio.2011.08.026. PMC 3213684. PMID 21925158.
- ↑ Wolpert, Lewis (2015). Principles of Development (вид. 5th). Oxord University Press. с. 500.
- ↑ Dassule HR, Lewis P, Bei M, Maas R, McMahon AP (November 2000). Sonic hedgehog regulates growth and morphogenesis of the tooth (PDF). Development. 127 (22): 4775—85. PMID 11044393.
- ↑ Taylor MD, Northcott PA, Korshunov A, Remke M, Cho YJ, Clifford SC, Eberhart CG, Parsons DW, Rutkowski S, Gajjar A, Ellison DW, Lichter P, Gilbertson RJ, Pomeroy SL, Kool M, Pfister SM (April 2012). Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathologica. 123 (4): 465—72. doi:10.1007/s00401-011-0922-z. PMC 3306779. PMID 22134537.
- ↑ DeSouza RM, Jones BR, Lowis SP, Kurian KM (22 July 2014). Pediatric medulloblastoma — update on molecular classification driving targeted therapies. Frontiers in Oncology. 4: 176. doi:10.3389/fonc.2014.00176. PMC 4105823. PMID 25101241.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Lubik AA, Nouri M, Truong S, Ghaffari M, Adomat HH, Corey E, Cox ME, Li N, Guns ES, Yenki P, Pham S, Buttyan R (2016). Paracrine Sonic Hedgehog Signaling Contributes Significantly to Acquired Steroidogenesis in the Prostate Tumor Microenvironment. International Journal of Cancer. doi:10.1002/ijc.30450. PMID 27672740.
- ↑ Tabin C, Riddle R (February 1999). How Limbs Develop. Scientific American: 78.
- ↑ Charron F, Stein E, Jeong J, McMahon AP, Tessier-Lavigne M (2003). The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell. 113 (1): 11—23. doi:10.1016/S0092-8674(03)00199-5. PMID 12679031.
- ↑ Kolpak A, Zhang J, Bao ZZ (March 2005). Sonic hedgehog has a dual effect on the growth of retinal ganglion axons depending on its concentration. J. Neurosci. 25 (13): 3432—41. doi:10.1523/JNEUROSCI.4938-04.2005. PMC 1564194. PMID 15800198.
- ↑ Thewissen JG, Cohn MJ, Stevens LS, Bajpai S, Heyning J, Horton WE (May 2006). Developmental basis for hind-limb loss in dolphins and origin of the cetacean bodyplan. Proc. Natl. Acad. Sci. U.S.A. 103 (22): 8414—8. doi:10.1073/pnas.0602920103. PMC 1482506. PMID 16717186.
- ↑ Litingtung Y, Chiang C (October 2000). Control of SHH activity and signaling in the neural tube. Developmental Dynamics. 219 (2): 143—54. doi:10.1002/1097-0177(2000)9999:9999<::AID-DVDY1050>3.0.CO;2-Q. PMID 11002335.
- ↑ Placzek M (August 1995). The role of the notochord and floor plate in inductive interactions. Current Opinion in Genetics & Development. 5 (4): 499—506. doi:10.1016/0959-437X(95)90055-L. PMID 7580143.
- ↑ Teillet MA, Lapointe F, Le Douarin NM (September 1998). The relationships between notochord and floor plate in vertebrate development revisited. Proceedings of the National Academy of Sciences USA. 95 (20): 11733—8. doi:10.1073/pnas.95.20.11733. PMC 21709. PMID 9751734.
- ↑ van Straaten HW, Hekking JW, Thors F, Wiertz-Hoessels EL, Drukker J (October 1985). Induction of an additional floor plate in the neural tube. Acta Morphol Neerl Scand. 23 (2): 91—7. PMID 3834777.
- ↑ Patten I, Placzek M (2000). Cellular and Molecular Life Sciences. Т. 57. с. 1695—1708. doi:10.1007/PL00000652.
- ↑ Martí E, Bumcrot DA, Takada R, McMahon AP (May 1995). Requirement of 19K form of Sonic hedgehog for induction of distinct ventral cell types in CNS explants. Nature. 375 (6529): 322—325. doi:10.1038/375322a0. PMID 7753196.
- ↑ а б в Ericson J, Morton S, Kawakami A, Roelink H, Jessell TM (November 1996). Two critical periods of Sonic Hedgehog signaling required for the specification of motor neuron identity. Cell. 87 (4): 661—73. doi:10.1016/S0092-8674(00)81386-0. PMID 8929535.
- ↑ Chiang C, Litingtung Y, Lee E, Young KE, Corden JL, Westphal H, Beachy PA (October 1996). Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature. 383 (6599): 407—13. doi:10.1038/383407a0. PMID 8837770.
- ↑ Placzek M, Tessier-Lavigne M, Yamada T, Jessell T, Dodd J (November 1990). Mesodermal control of neural cell identity: floor plate induction by the notochord. Science. 250 (4983): 985—8. doi:10.1126/science.2237443. PMID 2237443.
- ↑ а б Wilson L, Maden M (June 2005). The mechanisms of dorsoventral patterning in the vertebrate neural tube. Dev. Biol. 282 (1): 1—13. doi:10.1016/j.ydbio.2005.02.027. PMID 15936325.
- ↑ Roelink H, Porter JA, Chiang C, Tanabe Y, Chang DT, Beachy PA, Jessell TM (May 1995). Floor Plate and Motor Neuron Induction by Different Concentrations of the Amino-Terminal Cleavage Product of Sonic Hedgehog Autoproteolysis. Cell. 81 (3): 445—455. doi:10.1016/0092-8674(95)90397-6. PMID 7736596.
- ↑ а б Помилка цитування: Неправильний виклик тегу
<ref>: для виносок під назвоюRibesне вказано текст - ↑ Chamberlain CE, Jeong J, Guo C, Allen BL, McMahon AP (March 2008). Notochord-derived Shh concentrates in close association with the apically positioned basal body in neural target cells and forms a dynamic gradient during neural patterning. Development. 135 (6): 1097—1106. doi:10.1242/dev.013086. PMID 18272593.
- ↑ Nanci, Antonio (2012). Ten Cate's Oral Histology: Development, Structure, and Function (вид. 8th). St. Louis, Mo.: Elsevier. ISBN 978-0-323-07846-7.
{{cite book}}: Проігноровано невідомий параметр|name-list-format=(можливо,|name-list-style=?) (довідка) - ↑ Thesleff I (2003). Epithelial-mesenchymal signalling regulating tooth morphogenesis. J. Cell Sci. 116 (Pt 9): 1647—8. doi:10.1242/jcs.00410. PMID 12665545.
- ↑ Hardcastle Z, Mo R, Hui CC, Sharpe PT (1998). The SHH signalling pathway in tooth development: defects in Gli2 and Gli3 mutants. Development. 125 (15): 2803—11. PMID 9655803.
- ↑ Bumcrot DA, Takada R, McMahon AP (1 April 1995). Proteolytic processing yields two secreted forms of sonic hedgehog. Mol Cell Biol. 15 (4): 2294—2303. PMC 230457. PMID 7891723.
- ↑ Ingham (2011). Mechanisms and functions of Hedgehog signalling across the metazoa. Nature Reviews Genetics. 12: 393—406. doi:10.1038/nrg2984. PMID 21502959.
- ↑ Porter JA, Young KE, Beachy PA (1996). Cholesterol modification of hedgehog signaling proteins in animal development. Science. 274 (5285): 255—259. doi:10.1126/science.274.5285.255. PMID 8824192.
- ↑ Pepinsky RB, Zeng C, Wen D, Rayhorn P, Baker DP, Williams KP, Bixler SA, Ambrose CM, Garber EA, Miatkowski K, Taylor FR, Wang EA, Galdes A (1998). Identification of a palmitic acid-modified form of human Sonic hedgehog. J Biol Chem. 273 (22): 14037—14045. doi:10.1074/jbc.273.22.14037. PMID 9593755. Архів оригіналу за 26 липня 2008. Процитовано 15 січня 2018.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Stanton BZ, Peng LF, Maloof N, Nakai K, Wang X, Duffner JL, Taveras KM, Hyman JM, Lee SW, Koehler AN, Chen JK, Fox JL, Mandinova A, Schreiber SL (March 2009). A small molecule that binds Hedgehog and blocks its signaling in human cells. Nat. Chem. Biol. 5 (3): 154—6. doi:10.1038/nchembio.142. PMC 2770933. PMID 19151731.
- ↑ Maclean K (January 2006). Humour of gene names lost in translation to patients. Nature. 439 (7074): 266. doi:10.1038/439266d. PMID 16421543.
- ↑ Cohen MM (July 2006). Problems in the naming of genes. Am. J. Med. Genet. A. 140 (13): 1483—4. doi:10.1002/ajmg.a.31264. PMID 16718675.
Див. також
- Хромосома 7
 | Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |
|










